Orígenes de la química
Evalúo mis conocimientos participando en la prueba-concurso en kahoot .
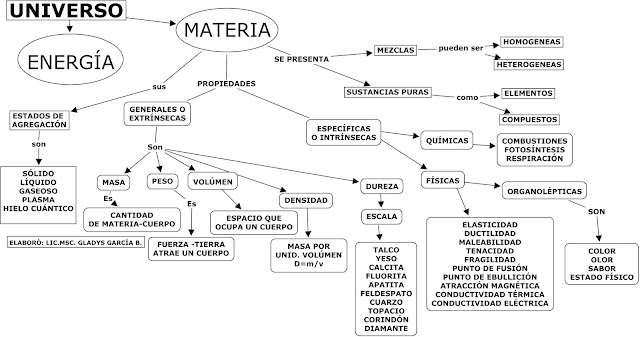
LA MATERIA
Taller Modelos Atómicos
1. Identificar las características de los modelos atómicos propuestos por Dalton, Thomson, Rutherfor y Bohr.
Actividad
Dibuja e interpreta los modelos atómicos, pulsando clic en el siguiente enlace:
http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/atomo/modelos.htm
Explica cada uno de los modelos atómicos.
¿Qué diferencia presenta el modelo actual del átomo?
Estructura del átomo
El núcleo contiene protones (partículas positivas) y neutrones (partículas neutras).
La corteza contiene electrones (partículas negativas).
Los átomos son eléctricamente neutros.
Número atómico: se refiere al número de protones que tiene un átomo y se representa con una letra Z.
Masa Atómica: se refiere a la suma de protones y neutrones que contiene un átomo. se representa con la letra A.
Los neutrones pueden ser diferentes en el mismo elemento, a esto de les llama Isotopos.
Modelo actual del átomo
El modelo actual del átomo presenta:
7 niveles de energía
Cada nivel tiene sus electrones repartidos en subniveles (s, p, d, f).
Cada subnivel tiene un número determinado de orbitales que pueden tener máximo 2 electrones en cada uno.
Los electrones giran en órbitas elípticas.
Tiene en cuenta el principio de Incertidumbre de Heisenberg.
El modelo actual se basa en la mecánica cuántica que estudia la naturaleza a escalas espaciales muy pequeñas.
Se basa en la observación de todas las formas de energía que se liberan en forma de cuantos.
1. Indica la región del espacio en donde existe mayor probabilidad de encontrar un electrón.
2. Determina las ecuaciones matemáticas para medir la amplitud
de onda que describe el electrón al rededor del núcleo.
3. el electrón se considera ahora como una nube difusa y no
como una partícula.
Para describir de forma completa el estado del electrón, son
necesarios cuatro números cuánticos:
n= indica el nivel (número cuántico principal)
l = indica los subniveles
m= describe los orbitales
s= señala es espín del electrón.
Actividad
2. Los Isotopos Carbono 12, Carbono 13 y Carbono 14 en qué se diferencian?
3. para que se utiliza el Carbono 14?
Notación Espectral :
Historia de la Tabla Periódica
En este momento iniciamos un proceso de reconocimiento de la tabla periódica y nos apoyamos en las Tecnologías de la Información y Comunicación (TIC) para adentrarnos en ese interesante aprendizaje.
Observa el siguiente enlace interactivo: https://www.lenntech.es/periodica/elementos/si.htm
¿Para qué sirven los metales alcalinos del grupo I?
Los metales alcalinos se encuentran en la naturaleza en forma de compuestos. Nunca en estado libre debido a que son muy reactivos.
Los metales alcalinos son muy importantes en los
tejidos vivos (dentro y fuera de la célula).
Observa y completa la siguiente tabla:
|
ELEMENTO |
SÍMBOLO |
USOS EN LA VIDA COTIDIANA |
|
Litio |
|
El principal uso industrial del litio
es en forma de estearato de litio como espesante para grasas lubricantes. En
cerámicas, en formulación de esmaltes para porcelana; en soldadura autógena y
soldadura para latón. |
|
Sodio |
|
|
|
Potasio |
|
|
|
|
¿Cómo identificar a los elementos alcalinotérreos del grupo II?
|
ELEMENTO |
SÍMBOLO |
USOS EN LA VIDA COTIDIANA |
|
Berilio
|
|
Se
emplea en la manufactura de estructuras aeroespeciales. El óxido de
Berilio se usa para elaboración de cerámicas y vidrios. |
|
Magnesio
|
|
Para la fabricación de espejos ópticos, en pirotécnica, en baterías secas, en la fabricación de flasch luminosos. Para funcionamiento de músculos y nervios, para mantener el sistema inmunitario saludable, mantiene constantes los latidos del corazón; ayuda a que los huesos permanezcan fuertes. |
|
Calcio
|
|
Forma parte de los dientes y huesos y contribuye a mantenerlos sanos. Es necesario para la coagulación de la sangre. Participa en la transmisión del impulso nervioso. En aleaciones con acero para piedras de los encendedores. |
|
Estroncio
|
|
Se
utiliza en la construcción de reactores nucleares. Es tóxico. Se usa para
endurecedor en aleaciones de Cobre. |
|
Bario
|
|
El
Bario se usa en pirotecnia. En sistemas de encendido de automóviles. En fuegos artificiales. Como contraste radiológico para examinar en el sistema
gastrointestinal. |
|
Radio
|
|
Es
intensamente radiactivo. Sus radiaciones pueden ser de tres tipos: rayos
alfa, rayos beta y
rayos
gamma. El cloruro de radio se usa en medicina para
producir radón, que se usa en tratamientos contra el cáncer. |
2. Consultar
los usos o aplicaciones que tiene las radiaciones del Radio: Rayos alfa, Rayos
Beta, Rayos gamma.
Completar las siguientes tablas las cuales contienen los elementos mas importantes de los grupos representativos de la tabla periódica.
Elementos más importantes del grupo III
EMENTO | SÍMBOLO | USOS EN LA VIDA COTIDIANA |
Boro
|
|
|
Aluminio
|
|
|
Elementos más importantes del grupo IV
LEMENTO | SÍMBOLO | USOS EN LA VIDA COTIDIANA |
Carbono |
|
|
Silicio
|
|
|
Elementos más importantes del grupo V
ELEMENTO | SÍMBOLO | USOS EN LA VIDA COTIDIANA |
Nitrógeno |
|
|
Fósforo
|
|
|
ELEMENTO | SÍMBOLO | USOS EN LA VIDA COTIDIANA |
Oxígeno |
|
|
Azúfre
|
|
|
ELEMENTO | SÍMBOLO | USOS EN LA VIDA COTIDIANA |
Flúor |
| |
Cloro
|
| |
Bromo Yodo |
ELEMENTO | SÍMBOLO | USOS EN LA VIDA COTIDIANA |
Hierro
|
| |
Cobalto
|
| |
Níquel
|
|
|
Cobre |
| |
Zinc
|
| |
Oro Plata Platino Mercurio
|
|
Enlace Covalente: actividad virtaul semana del 20 al 24 de abril
ELEMENTOS | ESTADOS DE OXIDACIÓN | |
Grupo I (Li, Na, K.. | +1 | |
Grupo II (Be, Ca, Mg.. | +2 | |
Grupo III ( B, Al… | +3 | |
Elementos de Transición | Fe, Co, Ni | +2, +3 |
Cu, Hg | +1, +2 | |
Au | +1, +3 | |
Ag | +2 | |
Zn, Cd | +2 | |
Grupo IV(C, Si… | +2, +4 | |
Grupo V ( N, P,…. | +1,+3,+5 | |
Grupo VI ( F, Cl, Br, I | +1, +3, +5, + 7 | |
|
Pregunta
problematizadora: ¿Cómo llega el oxígeno a las células de nuestro cuerpo? |
El oxígeno es un elemento químico que se ubica en
el grupo 6 de la tabla periódica, es gaseoso e incoloro, abundante en la
naturaleza.
Las plantas en el proceso de la fotosíntesis son
las encargadas de fabricar el oxígeno, el cual es liberado a la atmósfera, los
seres humanos y los animales lo incorporamos en la respiración, pasa a las
células para permitir el funcionamiento, luego lo liberamos al aire en forma de
Dióxido de Carbono.
ACTIVIDAD 1
1.
Consulta y explica que es la fotosíntesis
y escribir la fórmula química.
2.
¿Cuánto tiempo puede durar el ser humano
sin suministro de Oxígeno?
3.
¿Qué ocurre a nuestro organismo si le
falta oxígeno?
4.
Dibuja y explica el ciclo del oxígeno en la tierra.
Observa la siguiente imagen:
ACTIVIDAD 2
1. Escriba
los símbolos de los metales que se encuentran en la imagen anterior y sus
principales usos en la vida diaria.
2. Escriba
los símbolos de los no metales de la gráfica anterior y sus principales usos.
3. En que alimentos
se encuentra el fósforo, el hierro, el calcio, el nitrógeno y el carbono.
En la vida diaria la
palabra “óxido” nos
relaciona con muchos objetos metálicos (clavos, la lámina de los automóviles y
partes del motor, bisagras en las puertas, etc.) que al observarlos tiene una
capa negra o rojiza llamada herrumbre, corrosión u oxidación generalmente
corresponde a la acción combinada de la humedad y el oxígeno del aire sobre el
metal, por lo que podemos evitarla si protegemos al metal por ejemplo cubriéndolo
con pintura “de aceite”,.... y que mejor si ésta es “anticorrosiva.
Es importante comprender que
no todos los óxidos producen deterioro o daño a los metales, existen muchos
óxidos que presentan gran utilidad farmacéutica, cosmética e industrial. Vemos
los siguientes ejemplos:
Oxido de Magnesio: alivia los
malestares causados por la acidez del estómago.
Dióxido de Titanio: se emplea en la
fabricación de jabones, cremas, protector solar,
Dióxido de Carbono: se emplea en las
gaseosas para producir burbujas y darle el sabor.
1.
Consultar
el uso o aplicación de los siguientes óxidos
Oxido de Aluminio:
Oxido de Silicio:
Dióxido de Zinc:
Dióxido de Calcio:
Los óxidos en los alimentos:
En
la vida cotidiana vemos el efecto de los óxidos en los alimentos, cuando una
fruta se oxida es decir cuando al partirla se negrea; ocurre un proceso químico
que surge al entrar en contacto la fruta con el aire, y dependiendo de la
temperatura del lugar, será la rapidez con que se negrea o se oxida. Esto le ocurre
a la manzana, el banano y muchas otras frutas.
ACTIVIDAD
3
1.
¿Por
qué se les agrega agua con limón a las frutas como la manzana y el plátano para
que no se negreen?
2.
¿Qué
componentes químicos tiene el limón?
|
Copia en tu
cuaderno: Ahora nos adentramos en
las reacciones de la vida cotidiana que ocurren al uniese o reaccionar el
oxígeno con los no metales para formar óxidos ácidos o anhídridos. Antes de hacer
reaccionar al oxígeno con los no metales, recordemos que se encuentran en los
4,5,6, y 7 de la tabla periódica, debemos conocer los estados de oxidación
con los cuales reaccionar estos elementos. Observa en la tabla de la
izquierda: Si el elemento se
encuentra en el grupo 4, sus estados
de oxidación inician por más 4 y los pares inferiores, es decir +2.
Como en el caso del Carbono y el Silicio. Cómo son 2 estados de oxidación el
menor termina en oso y el mayor en ico. Veamos: 1.
Consultar que es el anhídrido
carbonoso o también llamado Monóxido de Carbono. 2.
Realice el gráfico o dibujo del
ciclo de Carbono. 3.
Escriba las reacciones del oxígeno
con el Silicio Si +2 y Si +4; y para que se utilizan Si el elemento químico se encuentra en el grupo 5, sus estados de oxidación serán: el número del grupo, es decir +5 y los impares inferiores a 5 es decir +3 y +1; por ejemplo, el Nitrógeno y el Fósforo. Ahora observa la siguiente tabla que nos sirve para dar los nombres a los anhídridos. Ejemplo: 4. Consultar
para que se utilizan los anhídridos del Nitrógeno 5. Dibujar
y explicar el ciclo del Nitrógeno. 6. Representar
las reacciones que se producen entre el Azufre y el Oxígeno y escribir sus
nombres. 7. Representar
el ciclo del Azufre (S) A
continuación, veamos las reacciones de elementos del grupo 7 cuando se unen
con el oxígeno: 8.
Consultar
para que se utilizan los anteriores Anhídridos del Cloro. 9. Represente las
reacciones entre le Yodo y el Oxígeno. 10. Para que se utilizan
los anhídridos del Yodo.
|
Hidróxidos o
Bases:
Los
hidróxidos se forman por la combinación de un óxidos básico y agua.
La fórmula general es M(OH)n dónde M es
el metal y n el número de oxidación del metal
Ejemplo:
Na2O + H2O produce 2NaOH
Hidróxido de Sodio.
Se utiliza
en la fabricación de pulpa y papel, jabón detergente, etc
Al2O3 + H2O produce 2Al(OH)3
Hidróxido de Aluminio
El
hidróxido de Aluminio se utiliza para la elaboración de desodorante en crema,
talcos y como antiácido.
Las bases se nombran con las palabras hidróxido
de seguidas del nombre del metal.
Nomenclatura: los nombres de las bases son
muy parecidos a los de sus óxidos.
Según el sistema de Nomenclatura Clásico:
1. Si el metal trabaja con un solo número de
oxidación se da el nombre genérico de hidróxido luego la preposición de y el
nombre del metal.
Ejemplo: NaOH
Hidróxido
de Sodio
Ca (OH)2
Hidróxido de Calcio
2. Si el
metal presenta dos
estados de oxidación diferentes, el de menor estado de oxidación termina
en oso y el de mayor estado de oxidación termina
en ico .
Ejemplo: Ni
(OH)2 Hidróxido
niqueloso
Actividad . Escribir los nombres de
los siguientes hidróxidos:
Fe (OH)2 , Fe(OH)3, Cu
(OH), Cu(OH)2, Co(OH)2 , Co(OH)3, AgOH, Zn (OH)2
Sistema Stock – Werner: Este sistema nombra a las bases
como hidróxido de luego el nombre del metal y con
números romanos entre paréntesis se escribe el número de oxidación del metal.
Ejemplo:
CuOH
Hidróxido de cobre (I)
Cu(OH)2 Hidróxido de cobre (II)
Pb (OH)2 Hidróxido de Plomo (II)
Pb (OH)4 Hidróxido de Plomo (IV)
Nomenclatura Racional o Sistémica: La
nomenclatura moderna nombra a las bases con el nombre genérico de hidróxido y
se le antepone el prefijo di, tri, tetra…según el número de OH, enseguida la
preposición de y el nombre del metal; cuando lleva un solo OH no se le antepone
el prefijo mono.
Ejemplo:
NaOH Hidróxido de Sodio
Ca (OH)2 Dihidróxido de Calcio
Cu OH Hidróxido de Cobre
Cu (OH)2 Dihidroxido de Cobre
Actividad . Completar la siguiente tabla:
|
Hidróxido |
Nomenclatura Clásica |
Nomenclatu.Stock-Werner |
Nomenclatura Moderna |
|
Na OH |
|
|
|
|
KOH |
|
|
|
|
Mg(OH)2 |
|
|
|
|
Al(OH)3 |
|
|
|
|
Sn(OH)2 |
|
|
|
|
HgOH |
|
|
|
|
Hg(OH)2 |
|
|
|
|
Ba(OH)2 |
|
|
|
|
Cu(OH)2 |
|
|
|
LABORATORIO DE ÁCIDOS Y BASES
OBJETIVOS
1. Observar
y clasificar sustancias de uso cotidiano como ácidos y bases.
2. Comprender
la distribución universal e importancia de ácidos y bases.
3. Entender
las funciones que cumplen los ácidos y las bases en nuestro cuerpo.
PRERREQUISITOS:
1. Conocer
los conceptos básicos de ácidos y bases.
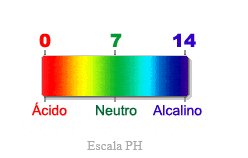
2.
Reconocer la escala de pH (Grado de acidez y
basicidad de una sustancia)
INTRODUCCIÓN
TEÓRICA
Los ácidos y bases
son los dos tipos de sustancias más comunes en el laboratorio y en el mundo
cotidiano. A finales del siglo XIX, Arrhenius formuló la primera
definición:
ÁCIDO: Toda sustancia capaz de ceder protones (H+).
BASE: Toda sustancia capaz de ceder oxhidrilos (OH-).
Considerando que el agua, H2O es el solvente por excelencia y
puede actuar como aceptor o dador de H+.
MEDICIÓN DEL pH EN EL LABORATORIO
Existen muchas sustancias que pueden ser usadas
como indicadores ácido- base y todas tienen un valor particular de pH en el que
cambian de color o viran.
El
Papel tornasol o Papel pH es utilizado para medir la concentración de Iones
Hidrógenos contenido en una sustancia o disolución. Mediante la escala de pH,
la cual es clasificada en distintos colores y tipos.
El papel tornasol se sumerge en soluciones y luego
se retira para su comparación con la escala de pH.
Según la siguiente escala:
|
pH |
<
4 |
5 |
6 |
7 |
8 |
9 |
>
10 |
|
Color |
Rojo |
naranja |
amarillo |
verde |
azul |
índigo |
violeta |
1.
pH- metro:
aparato empleado para mediciones de pH más precisas. Consta de dos electrodos
MATERIALES
NECESARIOS
Tubos de ensayo
Gradilla
Beaker
Papel tornasol
Erlenmeyer
Pipetas
Probetas
SUSTANCIAS DE PRUEBA
Agua, detergente para lavadora, Jugo de limón, vinagre, champú, sal de mesa (NaCl), bicarbonato de sodio, leche,
naranja, pulpa de guayaba
PROCEDIMIENTO
A. CLASIFICACIÓN DE PRODUCTOS CASEROS COMO ÁCIDOS
Y BASES
1. Colocar
en tubos de ensayo las sustancias de prueba
2. Medir
el pH con el indicador universal
3. Completar
el cuadro del informe clasificándolas como ácidos o bases.
INFORME
DE LABORATORIO
1.
Completar el cuadro clasificando las sustancias
de prueba como ácidos o bases. Ordenarlas desde la más ácida a la más básica.
|
Sustancia de prueba |
Color |
pH |
Clasificación |
|
Agua |
|
|
|
|
Jabón de lavadora |
|
|
|
|
Sal de mesa |
|
|
|
|
Jugo de limón |
|
|
|
|
Vinagre |
|
|
|
|
Champú |
|
|
|
|
Leche |
|
|
|
|
Bicarbonato de sodio |
|
|
|
|
Jugo de naranja |
|
|
|
|
Pulpa de guayaba |
|
|
|
2. Consultar la composición química de las
anteriores sustancias o alimentos de uso cotidiano.










































No hay comentarios:
Publicar un comentario